立体定向放射外科属新兴的边缘学科,最早由瑞典Leksell教授于1951年提出。这种方法既不同于普通外科手术,没有切口、出血,也没有感染等手术常见的并发症。而是通过高能射线定向照射,达到外科手术损毁或去除病灶组织的目的。放射外科也不同于普通放射治疗,前者是通过聚焦的方式,一次性、大剂量照射靶区组织;后者则是依靠病变组织与正常组织对射线的不同敏感度,通过多次小剂量较大范围的照射来达到治疗目的。

1951年Leksell教授首次提出立体定向放射外科的概念。五、六十年代,他一直致力于研制一种利用定向高能射线聚焦的方法,破坏颅内某些核团,从而达到治疗目的的设备,以减少传统开颅手术可能出现的并发症。最初选用X线、质子射线和加速器作放射源,均因能量不足或结构复杂被废弃。直至1967年, Leksell和Larsson合作在瑞典Uppsala大学研制出第一台伽玛刀,放射源选用60钴,将其分为179个放射源呈半球状排列,所有射线在球心集中形成焦点,使组织经一次性极量照射后产生盘形坏死灶,而周围组织因放射剂量的锐减可免受损害。由于该设备机械精度高,放射性损毁灶边界清晰,尤如刀割样,加之60钴释放伽玛射线,故称之为伽玛刀。并因为诞生地的名称定型为U型。U型伽玛刀早期主要用于破坏脑内神经核团以治疗恶痛、帕金森氏病及精神病等。
1974年改进后的第二代B型伽玛刀采用201个60钴放射源,照射后可产生类球形的损毁灶,且可选用多个等中心照射点,并通过更换准直器的型号以治疗不同大小及不同形状的病变,适应证扩大到脑血管疾病和颅内肿瘤。1980年后,随着CT、MRI、DSA的发展,伽玛刀逐渐改善,机械误差缩小到±0.1mm,靶点定位多数采用CT、MRI等无创伤或高分辨率血管造影技术。与之相配套的计算机控制系统、剂量计划系统日臻完善。1998年,Elekta公司又推出了Leksell C型伽玛刀。这种全新的伽玛刀自动化程度有了极大提高。根据剂量计划设计,这种伽玛刀可自动监测准直器的更换,各靶点坐标的调节更换以及检测工作。使整个伽玛刀治疗工作进入自动实施计划、立体图像融合,极大地提高了治疗的精确度,避免手术中人为因素造成的误差。
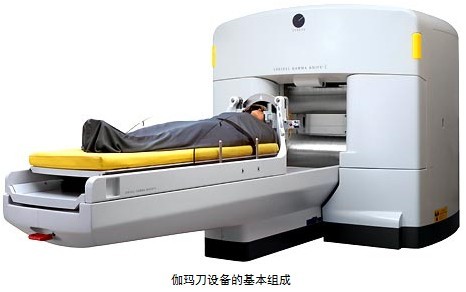
伽玛刀设备的基本组成
伽玛刀设备由伽玛射线源、准直器、移动手术床、控制系统、立体定向仪以及剂量计划系统等组成。
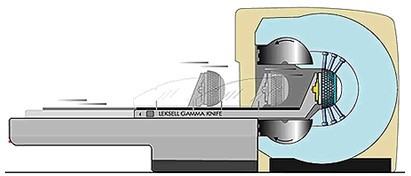
半球形排列的201个60钴源点分别安放于半球状的金属屏蔽系统内,初装时的放射总量为6000居里。半衰期约为5.27年。每一60钴源发出的伽玛射线经准直器校正后形成一个狭窄光束,并在球心部位形成交叉点,该焦点的放射强度约为400拉德/分。准直器分为内外二层,其上有201个孔洞。外层与60钴源一起固定于主体结构内,内层准直器为半球状头盔,可取出更换并固定在移动手术床支架上,其孔洞直径分别为4、8、14、18mm四种。改变不同型号的头盔便可改变伽玛射线光束的粗细,使其中心焦点的截面直径分别为6、11、20、24mm,也可通过堵塞部分孔洞而改变中心焦点截面的几何图形,使其与病变形状相符。移动手术床与伽玛刀主体结构相连,由固定构架、移动床和头盔支架组成。移动床将病人送入治疗位置时,联动主体结构使防护门打开,并进行照射。治疗结束后,移动床返回原位,防护门关闭。全部伽玛刀工作均由控制系统计算机控制,启动后整个治疗程序联动,并由定时、计时器自动控制照射过程及开闭机门。治疗过程中配有专用摄像系统监视病人情况,并通过双通道对讲系统与病人保持联系。
为伽玛刀配套的是专用的Leksell定向仪,由底环和四根立柱及镙钉组成,根据靶点位置,可以调整定向仪的安装位置,并可用X线、CT、MRI和DSA进行定位。

伽玛刀治疗的剂量计划系统有二种。早期使用Kula系统,计划过程为半计算机化、半手工的联合操作过程,比较耗时。近年来,随着计算机与图像处理技术的发展,新一代的剂量计划系统Leksell CammaPlan(LGP)问世。该系统集剂量计算、等剂量曲线绘制、图像显示以及治疗计划结果打印为一体,具有图像分辨率高、计算速度快、精确度高、内存容量大、操作简便等优点。
伽玛刀照射后的放射生物学改变
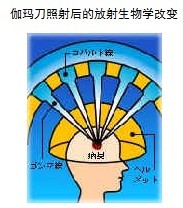
一次性大剂量接受伽玛刀照射后,受照组织中仅有部分细胞的DNA双螺旋链被高能射线所打断,这些细胞因不能正常代谢而迅速死亡和破裂。同时,受照组织中的毛细血管壁也因射线作用而产生肿胀、变性、坏死、血管腔变窄、血液流动缓慢、血栓形成,最终造成血管闭塞,进一步使受照组织缺血缺氧,组织变性坏死。从而达到控制肿瘤生长的目的。根据病理改变的特点可分为三个期。
1. 坏死期:一次性接受200Gy极量照射后3~4周即可观察到受照组织内出现坏死和急性退行性炎性反应改变。
2. 吸收期:这一期以细胞活动为其特点。吞噬细胞自病变中心开始清除坏死碎片,同时胶质疤痕开始形成。坏死区周围有胶质细胞增生,偶尔还可见到巨核细胞。病灶边缘还可见到慢性炎性反应、新生毛细血管形成和血管内充血、圆细胞增生。此期大约持续一年以上。
3. 晚期:此期的特点是永久性疤痕形成,病灶处于稳定状态,炎性反应消退。
需要指出,上述典型的伽玛刀照射后的放射生物学改变,是通过照射动物的正常脑组织以及癌痛患者接受止痛治疗后尸解资料所获得。对于不同类型的肿瘤来说,由于对放射线的敏感性不同,各期的病理变化时相也就不同。如转移瘤在治疗后一月,影像学即可表现肿瘤体积的明显缩小,三个月后,部分肿瘤可完全消失,影像学可恢复正常。而脑膜瘤治疗后,影像学的改变并不明显。
伽玛刀手术过程
伽玛刀手术治疗过程包括定位头架安装、头皮距的测量、定位扫描、剂量计划和治疗五个部分。
1. 定位头架安装
病人术前无须剃头,仅行头发头皮清洗消毒。除年幼或不合作患者外,绝大多数在局麻下通过特制金属镙钉,将Leksell定位头架固定于颅骨上。

安装时,可根据病人的状态,选择坐位或卧位。对气管插管全麻的病人,宜在插管结束后选择卧位安装头架。操作人员应根据病灶的位置选择适当长度的四根竖柱安装并固定在头架基环的相应位置,并将基环从上向下套入病人头部,调整头架位置。使病灶的位置尽量接近头架的中心处。对于多发病灶者,应使框架尽量满足多个病灶的一次性治疗。为了避免头架安装过于偏侧方,造成定位框不能顺利安放,可先将定位框安装于头架上,待模拟确定安装位置后,再移去定位框。
在病人额部及顶枕部预选的四个固定点上进行消毒并局部麻醉,经四根竖柱顶端的螺孔旋入四颗螺钉,将头架直接固定在病人的颅骨上。每颗螺钉在影像扫描的轴位上至少应距离病灶10mm以上,否则将影响图像的清晰度和准确度。如果病灶的X、Y坐标相对较偏,应尽可能将头架安装得低一些,以使Z坐标尽量偏小,而且螺钉的外露部分应尽量短,否则将增加治疗时摆位的难度。头架底部亦不能无限制降低,否则不能进行标准化头皮距的测量。
2. 头皮距的测量
为了便于剂量计划,需要采用一种标准化的测量方法,以确定头颅的不同形态以及在定位头架中的特定位置。方法是在数十个特定的方向上测量立体定向头架中心点到头部表面的距离。测量时,用半球形气泡水准仪(如图8-7- )安装在框架上,分别测定顶点、4个纬度环和8个经度环的交点至头架中心的距离。经气泡水准仪上的各孔依次插入深度测量尺,当尺的前端触及头皮时记录该孔内尺子的刻度。将测量值输入计算机内,作为计算剂量时的参数。上述操作后即可行定位扫描。

3. 定位扫描
根据病变性质,可分别选用CT、MRI和血管造影等方法进行定位扫描。
(1). CT定位扫描: CT定位扫描时,定位框架与CT机之间的连接是通过CT定位适配器来完成的。CT定位适配器根据不同品牌的CT机型配置而成。主要有三大功能:一是作为定位头架与CT检查床之间的连接与紧固装置,以确保在整个定位扫描过程中,定位框架与CT机之间保持恒定的位置关系;二是具有调节定位框架角度的功能,以保证在定位扫描时,CT扫描面自始至终与头架基准面平行;此外,适配器还有衬托头部重量的作用。施行CT定位扫描时,先将定位架的三个基座缓慢插入适配器的卡座内,调整定位框架的角度,使定位激光线与框架上X=100mm的垂直线、Z=100mm的水平线相吻合,这时即可进行扫描。根据病灶的性质及大小,扫描层厚的选择可在1~3mm之间。一般来说,层厚愈薄,精确度愈高,但对比度则有可能降低。所获得的定位扫描图像,可通过网络直接传输进入伽玛刀剂量计划系统(LGP),亦可经磁带转入,或可洗出CT片后再经扫描进入剂量计划系统。
利用CT扫描定位精确度较高,但由于CT对软组织的对比分辨率较MRI低,且易受颅骨伪影的干扰,因而对于鞍区病变以及颅底疾患不宜选用CT定位。
(2). MRI定位扫描
MRI的定位框与CT相似,只是方形盒各面板内的“N”字形金属标志线由可灌注MRI显影剂的“囗”形标志管所替代。轴位图像上坐标的计算方法与CT也相同。MRI定位框通过一非磁性适配器与MRI扫描仪相连。根据MRI机型不同,适配器的形状以及连接方式也有不同。适配器在其左前、左后及右后位上有三个卡座,其中左前位旋钮可调节定位框前后方向的倾角,右后位旋钮调节定位框左右方向的倾角。定位扫描前,通过反复调节,使MRI扫描定位激光线与定位框前面板上X=100,左右面板上Z=100的标志线重合时,即可进行定位扫描。通常行轴位和冠状位定位扫描,层厚1~3mm,层间距可选为0~0.3mm,病灶越小,层厚应越薄。
由于MRI能提供多种不同的扫描序列,如果选用得当,对于病灶以及周围正常组织的显示优于CT。随着高新技术的发展,MRI定位技术正不断完善,尤其是高场强的MRI定位扫描的精确度不断提高,使MRI定位愈来愈受到临床医生的亲睐,且有逐渐取代CT定位扫描的趋势。目前已广泛地用于颅内病灶,尤其是鞍区、后颅凹、颅底以及某些功能性疾病的靶点定位。但需指出,由于MRI定位时对于磁场的均匀度要求甚高,任何进入扫描区内的磁性物质将会引起MRI图像的畸变,最终导致定位误差。因此,施行MRI定位前,应对病人的穿戴仔细检查,切忌带有磁性金属物进入扫描区内。此外,既往行手术治疗、颅内或身体其他部位留置有金属异物的患者,如内固定钢板或钢钉、金属动脉瘤夹、银夹等,均不宜选用MRI定位。
(3). 血管造影定位
血管造影的定位框依据所使用的剂量计划软件的不同而分为二种。一种是专为使用Leksell Gamma Plan软件系统的用户而设计,主体结构为有机玻璃制成的框架。其前面板和左侧面板内分别嵌有五枚“+”字形金属定位标志,而后面板及右侧面板内分别嵌有四枚“×”字形标志。拍摄血管造影片后,计算机根据标志点形态的差别,可自动区分各定位板并计算靶点的坐标位置。另一种定位框主体结构为金属制成,每一定位板边缘均有刻度标尺并嵌有铅线,可以在血管造影片上清楚显示。这种定位框主要供使用Kula软件系统的用户以及施行普通立体定向手术时使用。靶点坐标由操作者手工测量和计算。
同CT、MRI定位扫描一样,血管造影定位时,仍然需用适配器将定位头架固定于造影床头端。摄片时,需保证片盒与定位架平行,球管的中心射线尽可能通过框架的中心,摄片距离应尽可能恒定。通常需行正、侧位连续摄片,从一系列造影片中,选择出最能清楚显示病灶范围的片子作为剂量计划的依据。
4. 剂量计划
在完成对病灶的定位扫描后,即可进行计量计划。Leksell伽玛刀目前使用的剂量计划系统有Leksell Gamma Plan和/或Kula两种,尤以前者较为安全、准确和方便。无论应用哪种剂量计划系统进行计算,均离不开对以下与治疗有关的参数进行选择和调整。。

(1). 剂量矩阵
病灶靶点的剂量计算过程是在一个特定选择的正方体内进行,这一特定空间称为剂量矩阵,它的中心点为矩阵中心。剂量矩阵正方体被分为31×31×31个小方格,它在治疗计划系统中用栅格大小(Grid Size)来表示。每一栅格的选用范围在0.1mm~2.5mm之间,最小移动距离为0.1mm,故剂量矩阵的边长在3.1mm~77.5mm之间变化。
栅格大小的选择直接影响剂量分布的精确性。实验结果表明,对于同一靶点,照射剂量和照射时间随着栅格大小的变化而变化。栅格增大,由于计算不够精确,其治疗时间延长,照射剂量增大;反之,栅格缩小,其治疗时间和照射剂量也随之减少。因此,剂量矩阵的范围应根据病灶的大小,既能覆盖整个靶区,又尽可能减少“无效”范围。如果相邻部位有多个病灶,为了使剂量分布更加准确,相邻病灶应尽量放在同一剂量矩阵中进行计算。Gamma Plan 4.0以上版本的剂量计划系统已经开发出设置多个剂量矩阵中心、同时对颅内多个病灶进行剂量计划的功能。通过平衡各病灶区内的剂量权重,达到满意的剂量分布。
(2). 治疗角度(伽玛角)的选择
伽玛刀头盔内左、右各有一X坐标调节固锁装置,其内端连接一扇形抛面。该抛面可沿X轴旋转。通过转动抛面即可调节并固定头架在头盔内前后方向的倾角,即伽玛角。伽玛角的范围在40~140度之间,通常须根据靶点的位置以及形态来选择适当的伽玛角。一般来说,病灶靠近头颅前部,则宜选用较小的伽玛角;反之,病灶靠近头颅后部,则应选择较大的伽玛角。使用较小的伽玛角时,为使头颈充分后仰,应增加治疗床的高度;使用较大的伽玛角时,为保证呼吸道畅通,应降低治疗床高度或去掉治疗床垫。
(3). 靶点的设定及准直器的选择
在伽玛刀治疗过程中,所谓靶点是指根据病灶位置所选择的等中心照射点,每一等中心照射点在立体定向头架坐标系中均有特定的三维空间位置。靶点的多少除了取决于病灶的大小及形状外,还与组合选用的准直器有关。准直器有4、8、14、18 mm四种,多个不同直径准直器的恰当组合,即可设计出与病灶三维形态相近似的剂量分布图形。
对于形状不规则的病灶,除了可以选择不同大小的准直器搭配组合外,亦可采用调整不同靶点权重的方法。所谓权重,即指每个靶点在剂量分布中所占的比重。相同的准直器,某靶点权重越大,其照射时间越长,等剂量曲线所覆盖的范围也越大。所谓等剂量曲线是以照射中心为100%且逐渐向周围递减的百分比图。由于50%以上的曲线递减最为明显,故通常选择50%左右的等剂量曲线覆盖病灶的周边。实际应用中,亦可根据病灶的大小、病变的性质以及与周围重要组织结构的关系,将病灶周边等剂量曲线的选择范围扩大到40%~70%左右。
(4). 塞孔方式的选择
并非所有的剂量计划都必须选择塞孔方式来获得良好的病灶适形性。若采用前述的剂量计划技巧仍不能得到良好的剂量分布图形时,通过对部分准直器孔的适当栓塞,可以改变剂量曲线图形,以适应病灶形状的需要。此外,塞孔方法更多地被用于对病灶周围组织的保护,特别是对视通路、下视丘、脑干、颅神经、头皮等重要的组织结构的保护。塞孔方式可以自由设定。根据剂量曲线图形的变化,确定需栓塞的部位和塞子的数量。如对鞍区肿瘤治疗时,为减少对视通路结构的损伤,可将位于正前方3~5列的孔洞栓塞。栓塞后在照射剂量不变的情况下,照射时间则相应延长。
(5). 剂量的选择
伽玛刀治疗时所选用的剂量通常用中心剂量和边缘剂量来加以描述。一般来说,功能性疾病的治疗剂量常用中心剂量(亦称最大剂量)来表示,而非功能性疾病,如肿瘤、血管畸形等由于治疗结果更多地与病灶边缘所接受的最小照射剂量有关,因此常用边缘剂量(或称周边剂量)来表示。中心剂量与边缘剂量通过所选定的等剂量曲线来相互换算。计算公式为:
中心剂量=边缘剂量÷等剂量曲线
由于病灶的性质、病灶的大小以及病灶周围结构对射线的耐受性等均有较大差别,故在选择治疗剂量时,应根据上述因素综合考虑。一般而言,颅内良性肿瘤所需的治疗剂量偏低;而对于恶性肿瘤的治疗则需要较高的剂量。对于功能性疾病患者,若需在脑内制作损毁灶,所需的中心剂量则可高达100~180 Gy。容积较大的病灶,所需的治疗剂量应适当降低;相反,容积较小的病灶则可选用较高的剂量。病灶周围组织对放射线的耐受性也直接影响到治疗剂量的选择。其中头皮、视通路、脑干、颅神经等对放射线的耐受性最差,应予特别重视。此外,既往是否接受普通放射治疗、患者的年龄以及全身情况也是选择治疗剂量时应综合考虑的因素。
5. 治疗
(1). 靶点的设置
在完成上述工作并确定治疗剂量后,剂量计划系统计算机即可按要求输出整个治疗方案,并显示每一靶点的坐标值和治疗时间。根据这些参数即可进行伽玛刀治疗。治疗时,首先在定位基环的两侧Y方向上安置坐标调节游标,并根据该靶点的Y坐标,将坐标调节游标锁定在相应刻度上,经两名工作人员相互核对无误后,再调整Z坐标于相应刻度上,并再次进行核对。X坐标轴的调节栓位于头盔基底两侧,根据靶点的X坐标,先固定一侧的调节栓,并调整固定伽玛角,待病人头部缓慢送入头盔后,再将双侧X坐标调节栓与头架两侧的坐标调节游标衔接,最后固定另一侧的X坐标调节栓。为使患者在治疗过程有较舒适的体位,应根据伽玛角度的不同调整治疗床垫的高度。
(2). 晶状体的防护
由于眼睛内的晶状体对射线非常敏感,大剂量照射后容易引发放射性白内障,故对通过晶状体的射线束必须用塞子阻挡,以防损伤。由于射线孔在圆形头盔上均匀排列,因此,病人在常规平卧位接受治疗时,当眼球进入头盔内,来自患者腹侧面的射线束有可能通过晶状体;而当眼球位于头盔外时,来自患者背侧面的射线束在穿透头部组织后,也可能经晶状体穿出,同样应予阻挡。检测的方法是用手电光模拟射线束,经腹侧的准直器孔直接投照,对光线投照至双侧瞳孔的相应准直器孔均应予塞孔;背部射线束的检测是通过一特制的半圆形模拟支架,经手电光投照,若光线投射至双侧瞳孔,即代表此射线束经晶状体后穿出,也应堵塞该孔。经上述堵孔后,若照射剂量不变,则照射应相应延长。其计算公式如下:
如果没有其它栓塞方式时:
实际照射时间=计划照射时间×(201+堵眼数)÷201
如果有其它栓塞方式时:
实际照射时间=计划照射时间×(201-已堵数+堵眼数)÷(201-已堵数)
(3). 时间的设定
上述工作完成后,所有工作人员立即撤离治疗室。根据治疗计划结果,在控制台的计时器上设置实际照射时间。这时,伽玛刀处于待机状态,只要按下“治疗开始”按钮,屏蔽门即可打开,治疗床自动移向治疗位置。一旦头盔进入正确位置,两个正、负计时器即开始计时。治疗时间结束时,治疗床自动离开治疗位置,屏蔽门关闭。如果是多靶点照射,则需重复上述步骤,直到所有靶点全部照射完毕。整个治疗过程中,利用高分辨率摄像机对病人情况及伽玛刀的正常运行进行监控,并通过双通道对讲系统与病人保持联系。治疗结束后,将病人从头盔中卸出,扶离治疗室。
完成全部治疗后即可拆除头架。螺钉固定点处有时可见少量渗血,经压迫后多能自行止血。钉孔处可用消毒纱布覆盖,并用绷带包扎,一日后可自行摘除。
病人在治疗后一般无需特殊处理。仅免疫功能低下者需口服抗生素3~5天,同时适当休息。对于治疗靶点较多者,为预防术后急性放射反应,可适当进行脱水或激素治疗。对颅压高的病人,在治疗前或治疗期间,可静脉点滴甘露醇,以确保治疗过程的安全。并可在术后继续脱水和/或激素治疗1~2周。
定期随访是伽玛刀治疗后的一项重要内容。一方面可以了解疾病的预后和转归,另一方面,通过定期的随访,还能及时发现可能出现的并发症,便于及时处理。不同性质的病灶,需要随访的间隔时间也不同。随访时,除了了解临床表现的改变外,尚需根据病灶性质选择影象学检查,一般多应用CT/MRI检查。对于良性病变,通常每半年随访一次,随访时间应不少于两年。而对于恶性病变,多在1~3月后开始随访,以后每3~6月随访一次。
随访疗效评估与并发症的防治
立体定向放射外科治疗后的随访与疗效评估与开放性手术不同。后者主要以手术切除病灶的程度以及术后临床表现来实现的。而放射外科治疗后,一般来说,近期临床表现没有明显的变化,疗效的出现是一个延迟逐渐产生的过程。评价疗效的方法主要是以影像学检查肿瘤是否继续生长(增大),AVM是否缩小直至消失和临床症状的改善为主要依据。同时,由于放射外科治疗所引起的并发症大多也发生在治疗后1~18个月,因此,临床及影像学的随访就显得更为重要。
一、影像学改变与疗效评价
(一)头部肿瘤接受放射外科治疗后,影像学改变主要有以下几种类型:
1. 肿瘤迅速坏死、吸收,一个月后复查即可见肿瘤体积明显缩小,占位效应减轻。多见于头部恶性肿瘤。如脑转移瘤、生殖细胞瘤、松果体区肿瘤、部分胶质瘤、鼻咽癌、视网膜母细胞瘤等。
2. 早期肿瘤体积无明显变化,但出现肿瘤中心强化减弱,瘤周仍可有不规则环状强化。随着时间延长,部分肿瘤开始皱缩,体积缓慢减小。常见于颅内外良性肿瘤,如听神经瘤、脑膜瘤、三叉神经鞘瘤、垂体瘤等。
3. 治疗后短期内肿瘤仍有增大趋势,但进展缓慢。1~2年内肿瘤生长停滞,体积稳定不变。可见于颅内部分良性肿瘤,如听神经瘤、脑膜瘤、垂体瘤等。
4. 治疗后短期内肿瘤体积缩小或不变,经较长时间随访,肿瘤在原位或邻近部位复发,体积增大。常见于胶质瘤和部分脑转移瘤。
5. 治疗后肿瘤仍继续生长,体积增大。常见于部分恶性脑膜瘤、胶质瘤等。
一般认为,前三种影像学改变属放射外科治疗有效,而后二种则认为无效。影响放射外科治疗有效率的主要因素有:适应证掌握是否严格、病灶的大小、剂量计划的设计技巧以及适当的治疗剂量等。
(二)AVM治疗3~6月后,即可见畸形血管巢开始缩小。但畸形血管团明显缩小或消失多发生于治疗后1~2年,约占80%左右。CT或MRI可显示畸形血管巢体积减小,供血动脉和引流静脉逐渐变细,直至恢复正常。由于畸形血管周围脑组织受射线的影响,可出现暂时性血管源性脑水肿。经对症治疗后,大多数可恢复至术前水平。AVM治愈的标准应达到在脑血管造影时显示正常的血液循环时间,病理性血管完全消失,引流静脉消失或恢复正常。
二、并发症的防治
放射外科治疗后并发症的出现主要与病灶周围正常脑组织接受一定剂量的散射有关。这些组织内血脑屏障暂时性破坏,引起局部血管源性脑水肿。同时,部分神经纤维髓鞘脱落,严重时神经元变性坏死。如果这些病理改变比较局限或位于非功能区,临床上可以没有明显症状,仅仅在随访影像学上可以发现。但若水肿严重,形成明显占位效应,或位于功能区,则可出现相应区域的神经功能缺失症状。并发症出现的时间通常在治疗后1~18个月之内,尤以3~9月为高峰。随着时间的延长,放射反应大多可逐渐自行消退,仅有大约0~11%的患者遗留永久性的功能障碍。
并发症的出现除了与治疗剂量有关外,更主要是与病灶的容积有关。尤其是良性肿瘤,由于治疗后短期内体积不会有明显的缩小,若肿瘤容积过大,势必引起散射范围的增大,致使较多的正常脑组织一次性接受较大剂量的辐射。
预防并发症的发生,首先要选择好适应证。对于体积过大的肿瘤,仍应以手术切除为主,术后若有肿瘤残留,再考虑放射外科治疗。其次,精心设计剂量计划,最大限度地避免周围正常结构的损伤。第三,对于颅内某些对放射线特别敏感的结构(如视通路、脑干等)或特殊部位的某些病灶(如凸面或纵裂脑膜瘤),由于易出现较明显的放射反应,照射剂量的选择应特别慎重。第四,定期影像学随访,及早发现和预测可能出现的并发症,并积极进行预防性治疗。
放射外科治疗后并发症的出现大多由放射性脑损伤所致,药物治疗主要依靠皮质激素、脱水剂、神经营养药物以及对症治疗。多数病例经上述药物治疗后可以恢复到术前水平。少数因水肿严重,引起颅内压增高。药物治疗无效者,可考虑手术切除病灶或坏死脑组织。